γ-sekretaza jest enzymem błonowym, który bierze udział w sygnalizacji komórkowej przez cięcie innych białek występujących w błonie. Niewłaściwe przetwarzanie jednego z nich, białka prekursorowego amyloidu, prowadzi do nadmiernego uwalniania krótkich białek β-amyloidowych, będących bezpośrednią przyczyną choroby Alzheimera.
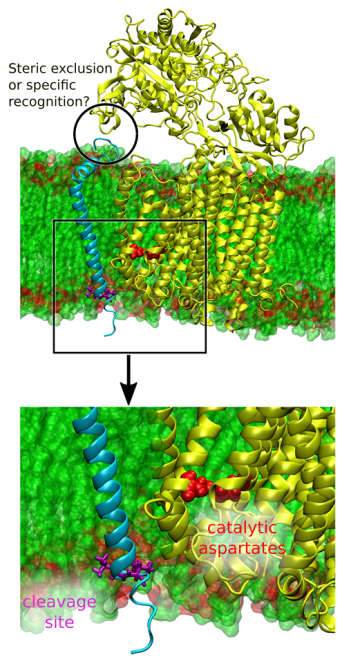
Dokładny sposób działania tego enzymu pozostawał nieprzenikniony głównie przez brak znajomości jego szczegółowej struktury. Sytuacja ta zmieniła się jednak od roku 2015, w którym to została poznana budowa tego enzymu dzięki metodom mikroskopii elektronowej. Pozwoliło to na wysnucie wielu hipotez odnośnie mechanizmu, zgodnie z którym enzym ten tnie inne białka błonowe. Weryfikacja tych hipotez jest jednak bardzo trudna na drodze eksperymentalnej, stąd naturalnym wydaje się zastosowanie metod symulacji komputerowych. Pozwolą one na dokładne prześledzenie drogi wiązania substratu przez enzym, która jest kluczowa dla samego procesu cięcia – pozwala mianowicie enzymowi na wybranie, które białka będą cięte, a które nie.
Prowadzone prace zorientowane są na szczegółowe poznanie mechanizmu rozpoznania i wiązania substratów białkowych przez γ-sekretazę. W pierwszej kolejności planujemy zidentyfikować rzeczywiste miejsce wiązania substratów do centrum katalitycznego γ-sekretazy. W dalszym etapie zamierzamy określić siły napędowe wiązania substratu oraz oddziaływania kluczowe dla prawidłowego wiązania substratu przez enzym. Planujemy również zweryfikować proponowany w literaturze mechanizm rozpoznawania substratów przez γ-sekretazę. Uzyskana wiedza może pozwolić na zaprojektowanie zupełnie nowego typu leków, które będą specyficznie hamowały cięcie prekursora polipeptydów β-amyloidowych. Poznanie drogi działania tego enzymu pozwoli również na pogłębienie zrozumienia sposobu, w jaki komórka odbiera i przetwarza sygnały zewnętrzne.