Mimo że informacja genetyczna zawarta jest w sekwencji nukleotydowej, dopiero związanie specyficznych sekwencyjnie czynników białkowych do wybranych sekwencji na nici DNA umożliwia skoordynowaną w czasie i przestrzeni interpretację zapisanych tak danych. Kod, który determinuje przebieg tego procesu, jest o wiele bardziej złożony niż sam kod genetyczny – zależy od sekwencji, czynników sterycznych i geometrycznych, modyfikacji potranslacyjnych, obecności innych makromolekuł i konkurencji między różnymi typami oddziaływań.
Stąd jego charakter jest silnie probabilistyczny i zdegenerowany: te same sekwencje DNA mogą być rozpoznawane przez różne białka, a jednocześnie te same białka mogą się wiązać do różnych sekwencji.
Proces dynamicznego poszukiwania sekwencji docelowej przez białka w warunkach komórkowych jest skomplikowany. W komórkach eukariotycznych liczba potencjalnych miejsc wiązania osiąga kilka lub kilkanaście miliardów, a różnica powinowactwa pozwalająca na ich odróżnienie jest niewielka, w związku z czym „naiwnie” losowe przeszukanie wszystkich potencjalnych sekwencji byłoby zbyt czasochłonne dla komórki. Dlatego też białka wiążące DNA wykorzystują mechanizm tzw. ułatwionej dyfuzji (ang. facilitated diffusion), w ramach którego łączą tryb jednowymiarowego „ślizgania” (ang. sliding) wzdłuż helisy DNA i „skakania” (ang. hopping) pomiędzy segmentami nici chromatyny w trzech wymiarach.
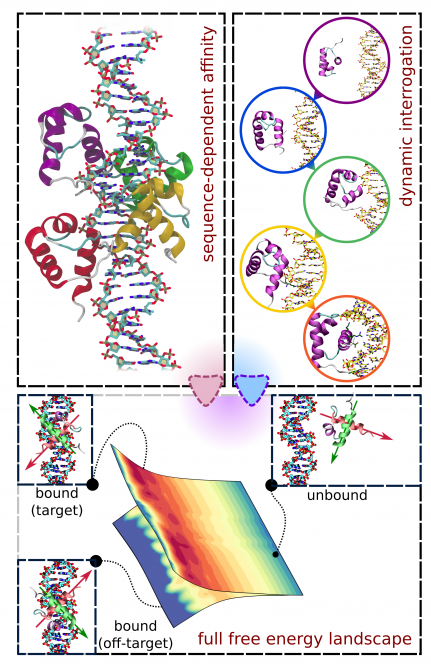
Badaną przez nas podgrupą białek specyficznie wiążących DNA są białka bezpośrednio wiążące DNA telomerowe. Telomery – struktury nukleoproteinowe obecne na końcach liniowych chromosomów – ukrywają zakończenia nici chromatyny przed mechanizmami naprawczymi, dla których niezabezpieczony koniec chromosomu byłby nieodróżnialny od wymagającego naprawy uszkodzenia DNA, a wiążące się do telomerów czynniki białkowe utrzymują funkcjonalność chromosomu m.in. w czasie przebiegu mitozy. Za funkcje te odpowiada kompleks białkowy zwany szelteryną, złożony z sześciu białek – TRF1, TRF2, POT1, TPP1, TIN2 i RAP1 – spośród których dwa pierwsze (TRF1, TRF2) bezpośrednio oddziałują z dwuniciowym DNA telomerowym, a kolejne (POT1) wiąże jednoniciowe DNA telomerowe zlokalizowane na tzw. 3’-naddatku. Co istotne, u ssaków sekwencja telomerowa składa się z tysięcy tandemowych powtórzeń motywu sześcionukleotydowego 5’-TTAGGG-3’, w związku z czym również miejsca wiązania odpowiednich białek przylegają do siebie. Taki układ – skrajnie różniący się od tego charakteryzującego np. typowe czynniki transkrypcyjne, gdzie miejsca wiązania występują pojedynczo – determinuje inną dynamikę białek związanych do telomerowego DNA: o ile wysokie specyficzne powinowactwo zapewnia ich lokalizację do odpowiedniej sekwencji, o tyle samo oddziaływanie nie jest statyczne i umożliwia powolną dyfuzję wzdłuż telomeru, regulując pośrednio stabilność struktur wyższego rzędu (pętle D/T, G-kwadrupleksy, szelteryna).
Kliknij, aby odtworzyć: